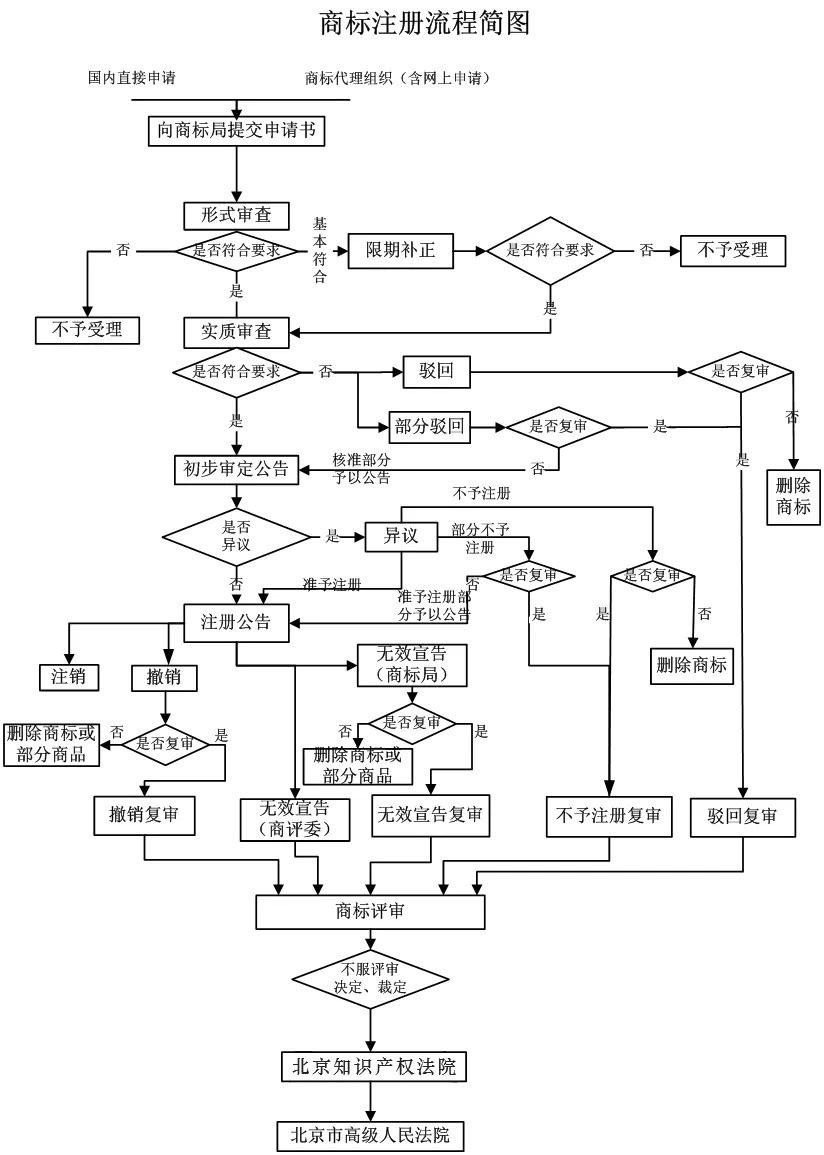
IVDR(In vitro Diagnostic Devices,体外诊断医疗器械)注册是一个涉及医疗设备和诊断技术领域的专业过程。通常,这个过程涉及到向相关监管机构提交申请,以获取允许产品用于临床或市场销售的许可。具体的注册流程和步骤可能会因地区和监管机构而异。
IVDR注册可能包括以下步骤:
1、了解相关法规和要求:在开始注册流程之前,需要详细了解相关的法规和标准要求。

2、准备申请文件:根据要求准备申请文件,包括产品技术文件、质量控制文件、临床数据等。
3、提交申请:将申请文件提交给相关监管机构。
4、审核和评估:监管机构会对申请进行审核和评估,可能包括现场审核和产品测试。
5、获得注册证书:如果申请获得批准,将获得注册证书,允许产品在特定地区或国家销售和使用。
具体的注册流程和步骤可能因国家和地区的法规而异,建议咨询当地的监管机构或专业机构,以获取详细的注册要求和流程信息,确保您的产品符合所有适用的质量和安全标准,以确保患者的安全和产品的有效性。